教学目的:
1.认识化学实验方案设计的重要性。
2.复习化学实验方案设计的基本要求。
3.化学探究性实验方案设计的原则和方法。
教学重点:
化学探究性实验方案设计的原则和方法。
教学难点:
设计化学探究性实验方案的体会和领悟。
课时安排:1课时
[引入]
化学实验是化学认识的源泉,是启迪学生思维、培养能力的有效途径,是培养学生科学态度、科学方法的必由之路,是培养学生创新意识和实践能力的重要手段。前面我们学习了化学实验方案设计的基本要求,请同学们归纳一下。
[学生回答,老师板书]
一、化学实验方案设计的基本要求
1.科学性
2.安全性
3.可行性
4.简约性
[引入]化学实验从传统的演示实验、验证性实验为主发展到探究性实验为主,教师通过启发性讲解,培养学生问题意识、实验探究和实验设计能力。
[板书]二、探究性实验设计的原则
1.科学性的原则。所设计的实验应该符合科学道理,不能凭空捏造。
2.对照性的原则。要设计一个对照性的实验,要想这个实验更能够说明问题,一定要有正反两个方面的实验。
3.等量性的原则。所设计的实验中的平行反应,试剂的取用应该是等量的。
4.单因子的变量原则。对某个实验的影响,会有很多的因素,实验正是要人为控制条件,使众多变量中,只能有一个因素是变量,其余几个是一样的。
[板书]三、探究性实验的设计
1.探索性探究实验的设计
这类实验方案设计过程重在分析比较,操作中的现象是对方案设计合理与否的检验,以及探究性结论得出的重要依据。学生对实验方案的设计思路可能会多种多样,实验方案相应也会教多,只要无明显失误或不妥,均可由学生通过实验进行验证,之后再将方案修正完善。
例1.含有酚酞的氢氧化钠的溶液中,滴加新制氯水,边滴边振荡,直到红色褪去。对于红色消失的原因,甲同学认为是氯气与水反应生成的HCl和HClO中和了NaOH所致;乙同学认为是氯气与水反应生成的HClO具有强氧化性使红色酚酞变成了无色的物质。
[分析]:如果红色消失的原因是因为酸碱中和,则红色可能重现,如果红色消失的原因是因为被氧化,则红色不可能重现。
[实验设计]:向上述刚好褪色的溶液中再滴入一些NaOH溶液,若红色重现,则是因为HCl和HClO的酸性所致;若红色不再重现,则是因为HClO的强氧化性所致。
例2.对于CO32−和HCO3−结合H+能力,甲认为HCO3−结合H+能力强,理由是在等质量的碳酸钠和碳酸氢钠固体中加入等体积等浓度的盐酸,碳酸氢钠固体中产生气体速率快;乙认为CO32−结合H+能力强,理由是在同一温度下同浓度碳酸钠溶液和碳酸氢钠溶液的pH,前者大于后者。
[分析]:CO32−与H+的反应是分步进行的:CO32− +H+ = HCO3− HCO3− + H+ = H2O+CO2,在碳酸钠和碳酸氢钠混合溶液里滴加盐酸,若CO32-结合H+能力强,则不会马上产生气泡,HCO3-结合H+能力强,马上有气泡产生。
[实验设计]:取相同体积、相同浓度的碳酸钠的碳酸氢钠溶液放入同一试管中,再滴加盐酸,如果马上有气泡产生,则是HCO3−先结合H+;如果是滴入一定量盐酸后才产生气泡,则是CO32−先结合H+。
例3.在室温下,把铜片放入浓硫酸中,没有明显的反应现象。对此,甲认为这是铜在浓硫酸里发生钝化现象;乙认为室温下铜片放入浓硫酸中看不到明显的现象,主要是因为铜与浓硫酸在室温下反应速率很慢。
[分析]:如果铜发生钝化,则表面会覆盖致密的氧化物薄膜,一般情形下难于反应。
[实验设计]:在烧杯中放入一块铜片,再加入适量的浓硫酸,使铜片浸没在酸中,稍待片刻,用镊子取出,用水洗净铜片表面的酸液。将用浓酸处理过的铜片放入盛有硝酸银溶液的烧杯中,观察现象。如果表面有白色的物质析出,溶液的颜色变蓝,说明铜在浓硫酸里没有产生钝化现象,乙的说法正确。如果表面没有白色物质析出,溶液的颜色也无明显变化,则甲的说法正确。
例4.加热稀氨水,溶液中的C(OH−)有什么变化?甲认为溶液中的C(OH−)增大,理由是NH3•H2O是弱电解质,在溶液中存在平衡:
NH3+H2O NH3•H2O NH4++OH− ,弱电解质的电离过程是吸热的,当升高温度后,平衡就会向电离的方向移动,所以氨水中的C(OH−)增大。乙认为一般加热有利于电离,但氨水受热时反而不利于NH3•H2O 的电离,这是因为受热时氨易逸出,下列平衡:NH3+H2O NH3•H2O NH4++OH−向左移动,使C(OH−)减小。
[分析]:C(OH−)改变可以由酚酞试液的颜色变化来判断。酚酞试液遇碱显红色,如氨水中的C(OH−)增大,则颜色变深;若氨水中的C(OH−)减小,则颜色变浅。
[实验设计]:在试管中注入滴有酚酞的氨水,并在试管口套上小气球(防止氨污染空气),加热,如颜色变浅,则加热使氨水中的C(OH−)减小,乙正确;如颜色变深,则加热使氨水中的C(OH−)增大,则甲正确。
[板书]2.验证性探究实验的设计
这类实验的目的主要是验证化学假说和理论,注意说服力要强。
例5.请结合所学知识设计实验,证实AlO2−结合H+的能力比CO32−强,供选试剂:NaOH溶液、AlCl3溶液、CuSO4溶液、pH试纸、NaHCO3溶液、FeCl3溶液(仪器自选)。
⑴应选试剂;⑵操作要点;(3)能证明AlO2−结合H+的能力强于CO32−的反应的原理的离子方程式。
[分析]:该实验为验证性实验,如果AlO2−和HCO3−相遇时,生成 Al(OH)3白色沉淀,即可AlO2−结合H+的能力强于CO32−
[解答]:⑴应选试剂:NaOH溶液、AlCl3溶液、NaHCO3溶液
(2)操作要点:①取少量的AlCl3溶液于试管中;②向试管中逐滴加入NaOH溶液直至产生白色沉淀恰好全部消失;③向其中再滴入NaHCO3溶液至足量。
(3)离子方程式:AlO2−+HCO3−+H2O = Al(OH)3↓+CO32−
[板书]3.综合性探究实验的设计
例6.已知镁能跟盐酸、醋酸反应,产生氢气。即:
Mg+2HCl = MgCl2+H2↑ Mg+2CH3COOH = Mg(CH3COO)2+H2↑
⑴请用镁粉、盐酸和醋酸为原料证明在同温同压下,当上述两种酸的物质的量相同时,反应产生的氢气的体积相同。
⑵若收集到的氢气体积不同,则请推测氢气体积不同的原因。
[分析]:⑴因为该实验是比较性实验,故在设计时要控制好两实验的条件(镁粉质量、盐酸、醋酸浓度体积要完全相同,产生氢气的实验装置要完全相同,实验时的外界温度压强要相同)。具体如下:A、组装如图装置
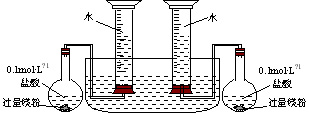
B、气密性检查
C、取下反应发生装置,分别加入镁粉和盐酸或醋酸,再重新连接好装置
D、打开分液漏斗向烧杯加入100mL 、0.1mol•L−1盐酸或100mL 、0.1mol•L−1醋酸
E、测量烧杯中水的体积,比较两次实验结果。
⑵影响生成氢气的体积大小因素有:一是产生氢气的量,所取的两种酸的浓度,量取两种酸的体积大小;实际参加反应的两种酸的量(因反应放热,两酸挥发而减小的程度不同)。二是收集氢气时的温度压强不同,由于两者酸性强弱不同,反应的剧烈程度不同,瞬间放出的热量不等,导致容器中的温度压强不同。
板书设计
化学探究性实验的设计案例
一、学实验方案设计的基本要求
1.科学性2.安全性3.可行性4.简约性
二、探究性实验设计的原则
1.科学性的原则
2.对照性的原则
3.等量性的原则
4.单因子的变量原则
三、探究性实验的设计
1.探索性探究实验的设计
2.验证性探究实验的设计
3.综合性探究实验的设计
[能力训练]
1.将双氧水溶液滴入含有酚酞的氢氧化钠溶液中,红色消失。甲认为这是由于H2O2是二元酸:H2O2 H++HO2−消耗了OH−,而使红色消失;乙认为双氧水具有强氧化性,将酚酞氧