教学设计方案二
课题 第一节 物质的量
第二课时
知识目标:
1.使学生了解摩尔质量的概念。了解摩尔质量与相对原子质量、相对分子质量之间的关系。
2.使学生了解物质的量、摩尔质量、物质的质量之间的关系。掌握有关概念的计算。
3. 进一步加深理解巩固物质的量和摩尔的概念。
能力目标:
培养学生的逻辑推理、抽象概括的能力。
培养学生的计算能力,并通过计算帮助学生更好地理解概念和运用、巩固概念。
情感目标:
使学生认识到微观和宏观的相互转化是研究化学的科学方法之一。培养学生尊重科学的思想。
强调解题规范化,单位使用准确,养成良好的学习习惯。
教学重点:摩尔质量的概念和相关计算
教学难点:摩尔质量与相对原子质量、相对分子质量之间的关系
教学方法:探究式
教学过程
[复习提问]什么是物质的量?什么是摩尔?它们的使用范围是什么?
[回答]物质的量是表示物质所含粒子多少的物理量,摩尔是物质的量的单位。每摩尔物质都含有阿伏加德罗常数个粒子,阿伏加德罗常数的近似值为 ![]() 。物质的量和摩尔都只适用于微观粒子,不能用于宏观物体。在使用物质的量时应该用化学式指明粒子的种类。
。物质的量和摩尔都只适用于微观粒子,不能用于宏观物体。在使用物质的量时应该用化学式指明粒子的种类。
[引言]既然物质的量是联系微观粒子和宏观物质的桥梁,那么如何通过物质的量求出物质的质量呢?也就是说1mol物质的质量到底有多大呢?我们先填写下面的表格,看是否可以从这些数据中得出有用的结论。
vAlign=top width=77>粒子符号
vAlign=top width=60>物质的
式量
vAlign=top width=110>每个粒子的质量
(g/个)
vAlign=top width=99>1摩尔物质含有的
粒子数(个)
vAlign=top width=92>1摩尔物质质量
(g)
vAlign=top width=77>![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
[答案]C的相对原子质量为12,1mol碳原子含有 ![]() 个碳原子,1mol碳原子的质量为
个碳原子,1mol碳原子的质量为 ![]() 个
个 ![]() 。同理Fe的相对原子质量是56,1mol铁原子含
。同理Fe的相对原子质量是56,1mol铁原子含 ![]() 个铁原子,是56g。
个铁原子,是56g。 ![]() 的相对分子质量是98,1mol硫酸含
的相对分子质量是98,1mol硫酸含 ![]() 个硫酸分子,是98g。
个硫酸分子,是98g。 ![]() 的相对分子质量是18,1mol水含
的相对分子质量是18,1mol水含 ![]() 个水分子,质量是18g。电子质量过于微小,因此失去或得到电子的质量可忽略不计,所以
个水分子,质量是18g。电子质量过于微小,因此失去或得到电子的质量可忽略不计,所以 ![]() 的式量是23。1mol钠离子含有
的式量是23。1mol钠离子含有 ![]() 个钠离子,是23g。
个钠离子,是23g。 ![]() 的式量为17。1mol氢氧根离子含
的式量为17。1mol氢氧根离子含 ![]() 个氢氧根离子,是17g。
个氢氧根离子,是17g。
[学生思考]由以上计算结果可得出什么规律?
[结论]①1mol任何原子的质量在数值上等于这种原子的相对原子质量。
②1mol任何分子的质量在数值上等于这种分子的相对分子质量。
③1mol任何离子的质量在数值上等于这种离子的式量。
(此处还可以用其他方法引入得出结论。例如:通过推导得出
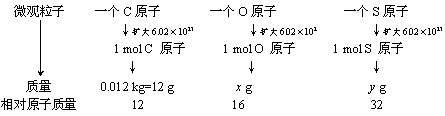
[讲解]因为任何一种原子的相对原子质量,是以12C的1/12为标准所得的比值。所以,1 mol任何原子的质量比,就等于它们的相对原子质量比。由此我们可求出x值和y值。
计算得出x=16g y